Persamaan Reaksi Redoks Sederhana
Persamaan Reaksi Redoks Sederhana
Jika
pada topik sebelumnya kalian telah belajar tentang bilangan oksidasi, pada
topik kali ini kalian akan belajar tentang persamaan reaksi redoks sederhana.
Agar kalian mengerti, yuk simak dengan baik topik ini.
Persamaan Reaksi Redoks Sederhana
Reaksi Redoks
Reaksi
redoks merupakan singkatan dari reaksi reduksi dan oksidasi. Setiap terjadi
reaksi reduksi, terjadi pula reaksi oksidasi atau bisa dikatakan reaksi redoks
berlangsung secara serentak. Perlu kalian ketahui, ada banyak reaksi redoks
yang tidak dapat dijelaskan dengan konsep pengikatan atau pelepasan oksigen
maupun transfer elektron. Perhatikanlah beberapa reaksi redoks di bawah ini.
a) CO2 (g ) + 4H2 (g )
→ CH4 (g ) + 2H2O (l )
b) I2 (g ) + 3Cl2 (g)
→ 2ICl3 (g )
c) Cu (s ) + HNO3 (aq )
→ Cu(NO3)2 (aq ) + NO2 (g ) + H2O (l )
d) Na2S2O3 (aq ) +
2HCl (aq ) → 2NaCl (aq ) + H2O (l ) + SO2 (g ) + S (s )
Oleh
karena hal tersebut, para pakar kimia mengembangkan konsep alternatif, yaitu
dengan perubahan bilangan oksidasi. Menurut konsep ini, jika pada suatu reaksi
bilangan oksidasi atom meningkat, maka atom tersebut mengalami oksidasi.
Sebaliknya, jika bilangan oksidasinya turun, maka atom tersebut mengalami
reduksi.
Untuk
mengetahui suatu reaksi tergolong reaksi redoks atau bukan berdasarkan perubahan
bilangan oksidasi, perlu diketahui biloks dari setiap atom, baik dalam pereaksi
maupun hasil reaksi. Perhatikan contoh reaksi redoks sederhana berikut:
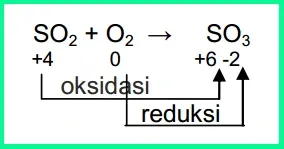
SO2 +
O2 → SO3
Berdasarkan
aturan penentuan biloks, jumlah biloks unsur-unsur dalam SO2, O2, dan SO2adalah
0. Biloks O dalam SO2 dan SO3 = –2, maka biloks S dalam SO2 = +4
dan biloks S dalam SO3 = +6. Reaksi tersebut dapat dinyatakan dalam
diagram berikut.
Berdasarkan diagram
tersebut dapat disimpulkan bahwa:
a)
atom S mengalami kenaikan biloks
dari +4 menjadi +6, peristiwa ini disebut oksidasi;
b)
atom O mengalami penurunan biloks
dari 0 menjadi –2, peristiwa ini disebut reduksi.
Dengan demikian,
reaksi tersebut adalah reaksi redoks. Di dalam reaksi redoks terdapat zat-zat
yang berperan sebagai pengoksidasi (oksidator) dan pereduksi (reduktor).
Oksidator adalah atom yang menyebabkan atom lain mengalami oksidasi. Sebaliknya,
reduktor adalah atom yang menyebabkan atom lain mengalami reduksi.
Reduktor = mengalami oksidasi
Contoh Reaksi Redoks
Pada
reaksi diatas, MnO2 bertindak sebagai oksidator dan HCl sebagai reduktor,
sedangkan MnCl2 sebagai hasil reduksi dan Cl2 sebagai hasil oksidasi.
Coba kalian perhatikan, oksidator dan reduktor pada reaksi tersebut merupakan
zat yang berbeda. Jika dalam reaksi redoks kalian menemukan zat yang sama
berperan sebagai oksidator sekaligus reduktor, maka reaksi tersebut disebut reaksi
autoredoks atau reaksi disproporsionasi.
Contoh Reaksi Autoredoks
Pada
reaksi di atas, tampak bahwa Cl2 mengalami oksidasi menjadi HClO dan
mengalami reduksi menjadi HCl. Hal ini berarti Cl2 berperan sebagai
reduktor sekaligus sebagai oksidator. Dengan demikian, reaksi tersebut termasuk
reaksi autoredoks. Adapun kebalikan dari reaksi autoredoks adalah reaksi
konproporsionasi, yaitu reaksi redoks yang mana hasil reduksi dan hasil
oksidasi merupakan zat yang sama.
Contoh Reaksi Konproporsionasi
Pada reaksi di atas,
tampak bahwa hasil oksidasi dan hasil reduksinya sama yaitu belerang.
Nah, sekarang kalian
sudah paham bukan tentang persamaan reaksi redoks sederhana? Agar pemahaman
kalian bertambah, yuk kerjakan soal-soal latihan yang ada.





Post a Comment for "Persamaan Reaksi Redoks Sederhana"